요약 |
4가지 가정을 한 입자의 속도분포에 대한 통계치이다. |
정의상 가정 |
|
내용상 가정 |
1. 운동하는 기체는 모든 방향으로 동일한 운동을 한다. 2. 분자는 다른 분자와 충돌외에 어떠한 힘도 작용하지 않는다. 3. 분자는 부피에 널리 퍼져있고, 벽이나 다른 분자에 부딪히기 전까지 직선으로 움직인다. 4. 진동과 회전은 위치에너지로 취급하고 병진운동만을 운동에너지로 취급한다. |
공식 |
|
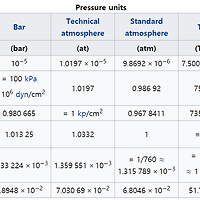
단위 |
|
응용 |
↑파란 박스의 글자를 클릭하시면 가정과 응용으로 넘어 가실 수 있습니다!!
기체에 관한 논의를 진행하기 전에
너무 복잡해지는 것을 막기위해 무시할수 있는 사항을 무시한다면, 다음과 같은 가정을 해야합니다.
1. 운동하는 기체는 모든 방향으로 동일한 운동을 한다.
2. 분자는 다른 분자와 충돌외에 어떠한 힘도 작용하지 않는다.
3. 분자는 부피에 널리 퍼져있고, 벽이나 다른 분자에 부딪히기 전까지 직선으로 움직인다.
기체라는게 결국에는 기체 분자들이 운동하는 것이므로
운동상태를 알기위한 가장 간단한 방법인
기체의 운동에너지를 확인해 보겠습니다.
여기서 기체는 병진운동(translation motion), 진동(vibrational states), 회전(rotational states)를 하고 있는데,
진동과 회전은 위치에너지로 취급하고 병진운동만을 운동에너지로 취급하겠습니다.
따라서

분자 한개 단위로 본다면 아보가드로수로 나눠 볼츠만상수
라 씁니다.
즉 입니다.
이 볼츠만 상수를 이용하여 속도를 표현한다면 3차원에서 방향은 3방향 이므로
따라서
이때 속도를 rms(root mean square) velocity로 쓴이유는 운동에너지의 평균값에서 속도를 도출해 내는 것이기 때문에 그렇게 씁니다.
즉 크기에 관한 정보로 평균속력을 의미하는 것이 아닙니다.
그렇다면 정확한 속도는 어떻게 알 수 있을까요?
바로 기체 안에 특정한 속도를 가진 분자가 몇개 있나로 확인 할 수 있습니다.
이것이 맥스웰-볼츠만 분포로 속도별로 몇개의 분자가 있는지 표현해 논것입니다.
즉 특정 속도 를 갖는 입자의 갯수를
라 한다면 이것의 밀도함수 식은 다음과 같습니다.
이때 m은 질량이고 N은 전체 입자의 갯수입니다.
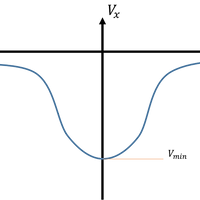
이것의 그래프는
입자가 가장 많은 속도 는
를 미분하여 0이되는 값을 알면 알 수 있고
평균속도 는 평균값을 구하면 알 수 있습니다.
식을 대략적으로 봐도 온도가 증가하거나 질량이 작아지면 속도가 전체적으로 커짐을 알 수 있습니다.
이때 미시적인 압력을 계산하기 위해 분자가 한 면의 끝에서 끝을 한번 갔다오는데 걸리는 시간을 t라 하고
압력을 계산하면 다음과 같습니다.
로 압력이 도출됩니다.
이떄

가 유도됩니다.
또한 기체가 충돌하기 전까지 이동한 평균거리인 mean free path의 경우
를 분자의 지름이라 할때
이 mean free path는 n에 반비례하므로 따라서 압력에도 반비례한다고 볼 수 있습니다.
갑자기 mean free path를 본 이유는 이것이 후에 반도체 공정에서 박막증착을 할때
분자들의 반응과 증착을 원활히 하기위한 chamber의 모양, 압력을 결정하는데 중요한 역할을하며
진공을 낮게 잡는 이유입니다.
이 기체도 흐르기 때문에 입자의 flux라 볼 수 있습니다.
즉 단위면적과 단위시간당 유입되는 가스 입자의 흐림이며 기본적으로 정육면체 공간을 생각한다면
면이 총 6개 이므로
으로 됩니다. 이를 더 일반적인 구의 모양으로 막 정리하다보면

따라서

여러가지 비례관계가 유도됩니다.
이는 진공 형성, 박막증착, 에칭 속도 제어에 중요한 역할을 합니다.
이 flux는 의미적으로 어느 위치에 도착하는 정도(arrival rate)로 볼 수 있고
이는 기체에 의해 오염되는 시간을 나타 낼 수 있습니다.
즉 어떤 기체 입자가 있고 이 입자가 점유하고 있는 표면적을 라 한다면, 그 표면적에 기체가 들어오는 flux를 곱한것의 역수는 오염되는 시간이 됩니다. 먼저 논의를 간단하게 하기위해 입자가 표면에 도달할때 붙는 정도를 sticking coefficient라 하고 100%붙는 다는것 (sticking coefficient=1)을 가정하면
분자 한개 monolayer가 형성되는 시간은
입니다. 계산해본다면 고진공이 아닌이상 엄청나게 빠른시간에 박막이 오염된다고 계산됩니다.
또한 문제가 되는게 한개가 더 있습니다.
가스 양의 단위가 조금씩 바뀐다는 것입니다.
온도 , 압력 P=1 atm에서 1mole의 가스를 가진 기체는 22.4liters를 점유합니다.(이때
)
단위 부피로 말하자면 위 조건에서 의 분자가 점유하고 있으며
Torr의 조건에도 나타낼 수 있는데,
를 나타내게됩니다.
그러나 온도가 달라질수록 실제 측정량에 변화가 생기게 됩니다.
다시말해 1 scc에 molecule의 갯수를 Torr로 나타낸다면,
이를 가스제어장비를 이용하는 경우 MFC(mass flow controller)에서 조절하는하는데 사용온도를 맞춰 해야 오차가 생기지 않습니다.
'물리학' 카테고리의 다른 글
| The harmonic oscillator (in quantum mechanics) (0) | 2017.03.29 |
|---|---|
| 퍼텐셜 우물(infinite potential well)_probability amplitude (0) | 2017.03.27 |
| 압력(pressure) (0) | 2017.03.25 |
| energy eigenstate (0) | 2017.03.24 |
| 시간 독립적 슈뢰딩거 방정식(TIme-independent Srödinger equation) (0) | 2017.03.24 |